PRACTICA 7: JUEGO DE COLORES.
HECHO POR: Aram yael cruz chavez 3°D #7
ESTA PRÁCTICA SE REALIZÓ EL: 9 de diciembre del 2016
HECHO POR: Aram yael cruz chavez 3°D #7
ESTA PRÁCTICA SE REALIZÓ EL: 9 de diciembre del 2016
OBJETIVO:Identificación de elementos mediante el color de la flama.
INVESTIGACIÓN: ¿Que es el espectro de emisión atómica? Investiga la composición de los fuegos pirotécnicos.
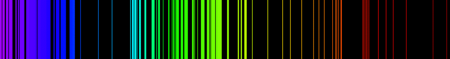
Espectro de Emisión atómica: El espectro de emisión atómica de un elemento es un conjunto de frecuencias de las ondas electromagnéticas emitidas por átomos de ese elemento, en estado gaseoso, cuando se le comunica energía. El espectro de emisión de cada elemento es único y puede ser usado para determinar si ese elemento es parte de un compuesto desconocido.
Composición de los fuegos artificiales:

Espectro de Emisión atómica: El espectro de emisión atómica de un elemento es un conjunto de frecuencias de las ondas electromagnéticas emitidas por átomos de ese elemento, en estado gaseoso, cuando se le comunica energía. El espectro de emisión de cada elemento es único y puede ser usado para determinar si ese elemento es parte de un compuesto desconocido.
 |
- El carbono, que provee el combustible.
- Los oxidantes, que producen el oxígeno para la combustión.
- El magnesio, que incrementa el brillo y la luminosidad.
- El antimonio, que da un efecto glitter (es un efecto que marca los halos de los brillos).
- El calcio, que da más intensidad a los colores.
Y para que los fuegos artificiales tengan colores característicos se necesita de:
- El sodio es el responsable de los amarillos y los dorados.
- El bario produce los verdes
- El cobre (carbonato de cobre / monocloruro de cobre) da lugar al color azul
- Las sales de estroncio dan el color rojo
- El titanio es el responsable de los destellos blancos y plateados.
BIBLIOGRAFÍA:
https://es.wikipedia.org/wiki/Espectro_de_emisi%C3%B3n
http://www.quo.es/ser-humano/la-quimica-de-los-fuegos-artificiales
HIPÓTESIS: La primera sustancia que nos toco fue el sulfato ferroso por que creemos que su coloración en la flama va a ser de color morado
HIPÓTESIS: Creemos que no todas las sustancias van a cambiar de color en la flama y van a ser iguales que el original
MATERIAL:
- Mechero de bunsen.
- Vidrio de reloj.
- Barra de grafito gruesa.
- Opcional: pinza universal.
- Lentes.
SUSTANCIAS:
- Agua.
- Cloruro de litio.
- Cloruro de sodio.
- Cloruro de cadmio.
- Cloruro de cobalto.
- Cloruro de estroncio.
- Sulfato cúprico.
PROCEDIMIENTO:
- Coloca una cantidad pequeña de agua en el vidrio de reloj.
- Anota el color original de las sustancias y completa el cuadro.
- Humedece la punta del grafito en el agua.
- Toma un poco de la primera sustancia con la punta del alambre o grafito. Acércala a la flama del mechero.
- Observa detenidamente el color que presenta la flama y anótalo en el cuadro.
- Introduce el grafito en el agua y limpia la punta con una franela húmeda y vuelve a sumergirlo en el agua.
- Repite la prueba de coloración a la flama con el resto de las sustancias.
OBSERVACIONES (IMÁGENES Y DESCRIPCIÓN):

Llenando el vaso para realizar el experimento

Conectando el mechero para iniciar el experimento



Las sustancias con las cuales vamos a realizar el experimento




Resultado de cada una de las sustancias

Llenando el vaso para realizar el experimento

Conectando el mechero para iniciar el experimento



Las sustancias con las cuales vamos a realizar el experimento




Resultado de cada una de las sustancias
CONCLUSIÓN: En cuento a las hipótesis estuvimos muy sorprendidos con los resultados obtenidos ya cada elemento contaba con su propio color en las llamas pero aunque estos se parecían si logramos identificar cada elemento por su color como lo indicaba el objetivo
No hay comentarios.:
Publicar un comentario